動物疫病檢測,作為健康養(yǎng)殖的關(guān)鍵一環(huán),在整體疫病預(yù)防控制中發(fā)揮著關(guān)鍵作用,具有提前預(yù)警評估風(fēng)險�,有效預(yù)防和減少疾病的發(fā)生等價值�。為支持客戶精準(zhǔn)防控���,健康養(yǎng)殖,信得科技引進了宋慶慶博士�����、涂亞斌博士�����、劉春國博士����、李秋博士等一批青年科學(xué)家,致力于將更多新穎想法與研究成果融入到產(chǎn)品研發(fā)和生產(chǎn)實踐中���,從而有效帶動信得科技的技術(shù)水平實現(xiàn)不斷提高與突破����。
近年來�,信得科技疫病檢測實力不斷提升,建有CNAS標(biāo)準(zhǔn)實驗室�����,現(xiàn)有30余位檢測精英�,配備110余臺(套)儀器和設(shè)備,年檢測樣本14萬余份�����。在劉春國博士的帶領(lǐng)和培養(yǎng)下�����,信得檢測人才迅速成長�,并于近日在國際家禽領(lǐng)域top期刊《家禽科學(xué)》上發(fā)表了以王雪博士為第一作者,劉春國博士為通訊作者的最新研究成果“同時檢測MG ts-11疫苗株和非ts-11株的Cycleave雙探針熒光定量PCR方法的開發(fā)和應(yīng)用”(https://doi.org/10.1016/j.psj.2024.103907)�����。該研究建立的cycleave雙探針熒光定量PCR方法具有良好的特異性����、敏感性和重復(fù)性,為MG ts-11疫苗株和非ts-11株的快速高效鑒別診斷提供了有力的技術(shù)支撐��。
以下為論文發(fā)表全文
同時檢測MG ts-11疫苗株和非ts-11株的Cycleave雙探針熒光定量PCR方法的開發(fā)和應(yīng)用
王雪��,孫娜娜���,王猛�,王慧,劉雨涵��,石豪����,朱浩,李培東����,張富友,楊天耀�,李朝陽,劉春國
摘要:雞敗血支原體(MG)ts-11活疫苗已成為預(yù)防和控制MG感染的有效方法��。然而����,ts-11株通常難以與非ts-11株,包括野毒株和其他疫苗株(F和6/85)進行區(qū)分�。因此,建立一種快速有效的方法來區(qū)分ts-11株和非ts-11株至關(guān)重要���。根據(jù)ts-11株pot C基因中存在一個單點突變的保守區(qū)域�,我們設(shè)計一對引物及鑒別疫苗毒和野毒的兩條探針。該方法能夠準(zhǔn)確���、高效地鑒別ts-11和非ts-11株,最低檢測限分別為2.43拷貝/μL和1.6拷貝/μL�。此外,該方法也具有良好的特異性��,禽流感病毒���、傳染性支氣管炎病毒�、新城疫病毒�、禽腺病毒、傳染性喉氣管炎病毒�����、傳染性法氏囊病病毒��、雞貧血病毒�����、馬立克氏病病毒��、滑液囊支原體和鼻氣管鳥桿菌檢測結(jié)果均為陰性。臨床樣品檢測結(jié)果表明����,該方法可有效進行ts-11和非ts-11株的混合感染或單一感染的檢測區(qū)分,而且批內(nèi)和批間變異系數(shù)較低�����。本研究建立的cycleave雙探針熒光定量PCR方法具有良好的特異性�����、敏感性和重復(fù)性��,為MG ts-11和非ts-11株的快速高效鑒別診斷提供了有力的技術(shù)支撐��。
關(guān)鍵詞:雞敗血支原體(MG)��,cycleave熒光定量PCR�,鑒別診斷,ts-11株
引言
目前�,已知有約23種支原體存在于鳥類中。其中�,最主要和最常見的感染雞的支原體包括雞敗血支原體(MG)和滑液囊支原體(MS)(Dhondt等,1998; Ross等,2014)����。MG是雞和其他禽類(Wang等,2022)慢性呼吸道疾?����。–RD)的主要病原體��。由于MG感染后可對家禽養(yǎng)殖業(yè)造成重大的經(jīng)濟損失�,MG被認(rèn)為是影響家禽(Mugunthan等�,2023)經(jīng)濟價值的最主要的致病性支原體。MG感染呈全球分布�,已被世界動物衛(wèi)生組織(WOAH)所收錄。MG可導(dǎo)致火雞傳染性鼻竇炎�����,北美雀類結(jié)膜炎���。MG也可引起一些鳥類發(fā)病���,包括美國金雀、紫雀和麻雀����,以及一些觀賞性鳥類���,包括雉類、鷓鴣和石雞(Mugunthan等�,2023)。在雞群中�,MG不僅引起CRD,還可與大腸桿菌和低致病性禽流感病毒等協(xié)同感染���,引起呼吸道疾?�。∟aylor等�����,1992)��。由于MG在禽類中具有較高的致病性���,給養(yǎng)殖業(yè)造成了巨大的經(jīng)濟損失,因此��,提高MG的診斷和防治水平至關(guān)重要。
MG可以水平傳播和垂直傳播���。水平傳播主要通過飛沫�����、唾液����、攜帶MG的氣溶膠以及被污染的飼料和飲用水����;通過雞胚的垂直傳播偶爾發(fā)生����。雞群中MG感染很難徹底清除,導(dǎo)致MG感染在雞群中長期存在并廣泛傳播��,使得MG感染的防控更加困難��。
疫苗免疫是預(yù)防MG感染的重要策略。目前���,6/85、ts-11和F株是世界范圍內(nèi)使用的主要活疫苗株。F菌株毒力強�,對肉雞和火雞均有致病性。6/85株和ts-11株是非常安全的��,對未免疫雞群的潛在傳播風(fēng)險較低(Noormohammadi and Whithear�����,2019; Vance等����,2008)。ts-11疫苗由澳大利亞生物資源公司研制(Whithear等����,1990)。ts-11株的最適生長溫度為33℃���,相關(guān)研究表明在39.5℃時疫苗株增殖能力下降��,說明ts-11株對溫度敏感�����。與親本株(80083株)相比���,ts-11株高度致弱�,可能對雞無致病性�。此外,ts-11株在鳥類間的水平傳播能力也較低���。研究表明�,ts-11疫苗對MG強毒株引起的呼吸道疾病和產(chǎn)蛋下降具有保護作用(Armour and Ferguson-Noel����,2015)。相反���,F(xiàn)株能夠在肉雞中傳播并引起呼吸道癥狀(Vance等����,2008; Rodriguez and Kleven����,1980)�。隨著ts-11疫苗的廣泛使用,區(qū)分疫苗株與非疫苗株已成為養(yǎng)殖業(yè)的迫切需求�����。常規(guī)的病原體分離培養(yǎng)方法無法有效區(qū)分疫苗株和非疫苗株。目前�,我國缺乏直接、快速�、靈敏和定量的方法來評估疫苗免疫后ts-11株的定植情況(Sulyok等,2019)��。因此����,建立有效的檢測方法來區(qū)分MG ts-11株與非ts-11株是控制MG感染的關(guān)鍵。
Cycleave熒光PCR已應(yīng)用于畜牧業(yè)�����、獸醫(yī)以及布病和肺癌等人類疾病的研究(Fujita等����,2015; Nan等,2016)����。該方法不同于傳統(tǒng)的熒光定量PCR,它結(jié)合循環(huán)探針技術(shù)提高了特異性���。Cycleave PCR檢測可以實時檢測單核苷酸多態(tài)性��。利用嵌合RNA-DNA 探針和RNase H來檢測目標(biāo)核苷酸����。嵌合探針含有一個RNA堿基,當(dāng)探針與互補DNA序列形成雜合體時�,該堿基可以被RNase H切割,探針裂解發(fā)出熒光信號�。如果探針的RNA部分或一個RNA堿基與模板不匹配,RNase H 無法切割探針的RNA部分����。在本研究中,開發(fā)了一種cycleave雙探針熒光定量PCR(cycleave qPCR)方法來區(qū)分MG ts-11株和非ts-11株����。利用RNA和DNA雜合循環(huán)探針,RNase H���,以及針對性引物,可以高效��、準(zhǔn)確地鑒別ts-11株和非ts-11株�����。該方法可在1小時內(nèi)鑒定出目標(biāo)株,從而實現(xiàn)MG的快速檢測以及ts-11疫苗株與非ts-11株的快速鑒別診斷�����。
材料與方法
病原
雞傳染性支氣管炎病毒(IBV)����、新城疫病毒(NDV)、禽流感病毒(AIV)��、禽腺病毒(FAdV)�、傳染性喉氣管炎病毒(ILTV)、傳染性法氏囊病病毒(IBDV)�、雞貧血病毒(CAV)、馬立克氏病病毒(MDV)�、MS和鼻氣管鳥桿菌(ORT)等均由山東信得科技股份有限公司檢測中心保存。所有病毒及MS和ORT均采用特異性PCR方法進行鑒定��。
引物和探針
研究表明�,pot C基因可作為鑒別ts-11疫苗株與野毒株(Sulyok等,2019)的靶基因��。從GenBank下載ts-11株 (CP044225.1)和代表性非ts-11株(野生型(CP006916.3)��、6/85(CP044224.1)和F株(NC017503.1))的pot C基因序列。利用Snap Gene軟件(version 3.1.4)針對ts-11株pot C基因中含有單點突變的保守區(qū)域設(shè)計引物���。采用金斯瑞qPCR(TaqMan)在線引物設(shè)計軟件設(shè)計探針(https://www.genscript.com/tools/real-timepcr-taqman-primer-design-tool)�。所用引物和探針由寶生物工程(大連)有限公司合成����,見表1。
表1 引物和探針序列
核酸提取及重組質(zhì)粒的制備
使用VNP-32P全自動核酸提取儀和諾維贊DNA/RNA提取試劑盒提取AIV��、IBV����、NDV、FAdV�、ILTV、IBDV����、CAV、MDV���、MS�����、ORT和所有拭子樣品的核酸��。重組質(zhì)粒pts-11和pnon-ts-11分別克隆有ts-11株和非ts-11株的pot C部分基因��,由寶生物工程(大連)有限公司合成�。
Cycleave qPCR反應(yīng)程序
Cycleave qPCR反應(yīng)體系為25 μL�����,包括12.5 μL的Cycleave PCR Mix(2×Conc.)����,上游引物(10 μM)和下游引物(10 μM)各0.5 μL,ts-11探針(5 μM)和非ts-11探針(5 μM)各1 μL���,模板2 μL�����,滅菌水7.5 μL����。反應(yīng)條件為95℃預(yù)變性30s;95℃變性10s����,60℃退火30s,72℃延伸20s��,共40個循環(huán)�����。延伸時進行熒光信號檢測�,根據(jù)擴增曲線和Ct值判斷結(jié)果。qPCR使用Roche Light Cycler 480進行��。以200 RFU的熒光信號作為cycleave qPCR檢測的閾值��,Ct≤36判為陽性��。
標(biāo)準(zhǔn)曲線的建立
用微量分光光度計測定pts-11和pnon-ts-11重組質(zhì)粒的濃度�����,并計算各自的拷貝數(shù)�����。然后將質(zhì)粒在無菌水中進行10倍倍比稀釋(108~103),作為cycleave qPCR的模板��。每個稀釋度重復(fù)3次�����,建立標(biāo)準(zhǔn)曲線�。反應(yīng)體系和程序同上�,利用軟件計算標(biāo)準(zhǔn)曲線參數(shù),包括效率�����、斜率和R2��。
特異性��、敏感性和重復(fù)性分析
為了驗證特異性�����,以提取的AIV���、IBV����、NDV、FAdV����、ILTV、IBDV�、CAV、MDV����、MS和ORT基因組為模板,進行cycleave qPCR擴增�����。并用104稀釋的pts-11和pnon-ts-11質(zhì)粒作為陽性對照�����,無菌水作為陰性對照�。
為了檢測cycleave qPCR的敏感性,將兩個質(zhì)粒分別做102~1011連續(xù)稀釋�����,作為cycleave qPCR和常規(guī)PCR的模板,以無菌水作為陰性對照�����。為了確定cycleave qPCR的重復(fù)性和穩(wěn)定性�,將pts-11和pnon-ts-11質(zhì)粒10倍倍比稀釋(104~106)作為cycleave qPCR的模板;在批內(nèi)和批間重復(fù)試驗中�����,每個樣品設(shè)置3個重復(fù)�。批間重復(fù)試驗的時間間隔為1周����。根據(jù)公式CV =(SD [ Ct值] /總體平均值[ Ct值])×100計算變異系數(shù)(CV)。
臨床樣品檢測
采集2022年山東��、黑龍江和廣東三省免疫MG ts-11疫苗35天后的10個規(guī)?���;u場的雞上顎裂拭子300份。樣品的采集經(jīng)山東信得科技股份有限公司實驗動物管理與倫理委員會批準(zhǔn)(QXRZ:2021-007)��。利用建立的Cycleave qPCR方法進行檢測�,同時與商品化MG通用qPCR試劑盒(英賽特)的檢測結(jié)果進行比對�����。此外���,從兩個飼養(yǎng)和管理條件相似,但MG疫苗免疫程序不同的大型養(yǎng)殖場采集臨床樣本��,以評估免疫效力�。
結(jié)果
標(biāo)準(zhǔn)曲線的建立
根據(jù)檢測結(jié)果繪制ts-11株和非ts-11株的標(biāo)準(zhǔn)曲線,見圖1和表2�。斜率分別為-3.303和-3.410,R2值分別為0.9993和0.9987�����,擴增效率分別為100.8%和98.4%�。ts-11株批內(nèi)重復(fù)性CV為0.32%~0.82%,非ts-11株批內(nèi)重復(fù)性CV為0.91%~1.13%����。此外,ts-11株批間重復(fù)性CV為0.40%~0.51%�,非ts-11株批間重復(fù)性CV為0.63%~0.95%(表3)。
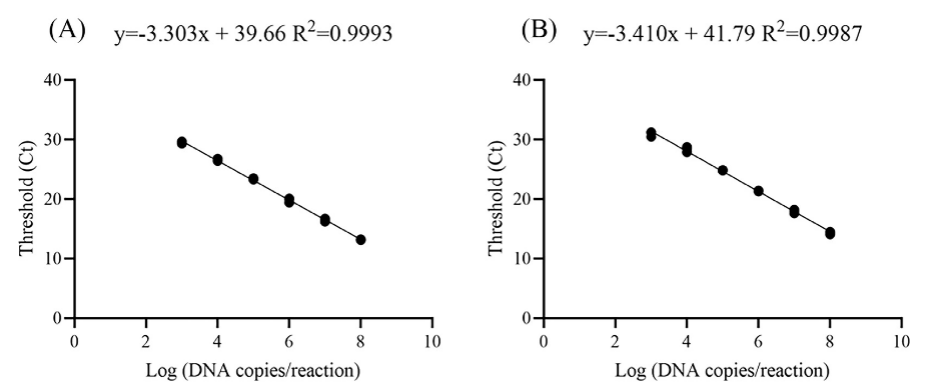
圖1. Cycleave qPCR標(biāo)準(zhǔn)曲線��。ts-11株質(zhì)粒pts-11從2.43×103倍比稀釋到2.43×108拷貝/mL(A);非ts-11株質(zhì)粒pnon-ts-11從1.65×103倍比稀釋到1.65×108拷貝/mL(B)���。
表2 Cycleave qPCR標(biāo)準(zhǔn)曲線結(jié)果
Cycleave qPCR方法的特異性��、敏感性和重復(fù)性
選取AIV�、IBV��、NDV�����、FAdV�、ILTV�、IBDV、CAV����、MDV、MS和ORT等常見雞源病原��,對建立的cycleave qPCR方法進行特異性驗證�。結(jié)果顯示,與陰性對照相同�,這些病原cycleave qPCR檢測結(jié)果均為陰性(圖2)�����。
圖2. Cycleave qPCR特異性評估�。ts-11疫苗株(A)��;非ts-11株(B)�����。P:陽性對照�;A:AIV;B:IBV���;C:NDV����;D:FAdV�;E:ILTV;F:IBDV�;G:CAV;H:MDV�;I:MS;J:ORT����;N:陰性對照��。
將質(zhì)粒進行10倍倍比稀釋�����,根據(jù)質(zhì)??截悢?shù)評估cycleave qPCR檢測方法的敏感性��。結(jié)果表明���,ts-11株(圖3A)和非ts-11株(圖3B)的cycleave qPCR敏感性分別為2.43拷貝/μL和1.65拷貝/μL����。常規(guī)PCR方法對ts-11疫苗株(圖4A)和非ts-11株(圖4B)的敏感性分別為2.43×103拷貝/μL和1.65×103拷貝/μL����。cycleave q PCR方法的敏感性比常規(guī)PCR方法高1000倍���。
圖3. Cycleave qPCR敏感性評估�����。ts-11株質(zhì)粒pts-11從102倍比稀釋到1010(A)��;非ts-11株質(zhì)粒pnon-ts-11從102倍比稀釋到1010(B)���。N:陰性對照��。
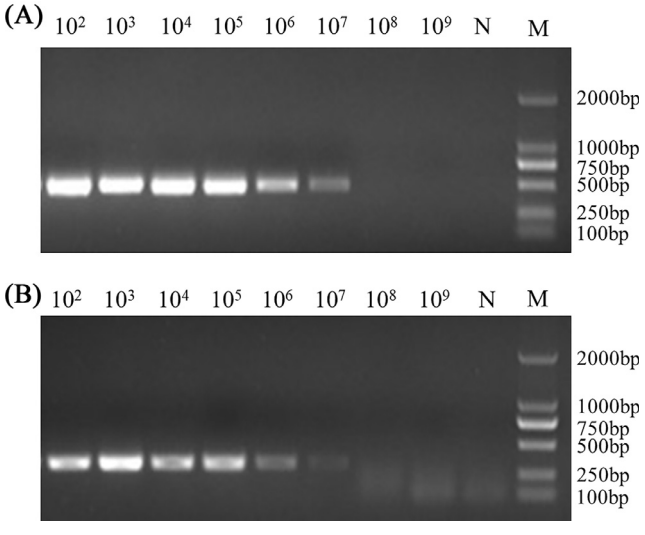
圖4. 普通PCR檢測ts-11株和非ts-11株電泳圖�����。ts-11株質(zhì)粒pts-11從102倍比稀釋到1010(A)��;非ts-11株質(zhì)粒pnon-ts-11從102倍比稀釋到1010(B)�。N:陰性對照�����;M:DNA標(biāo)準(zhǔn)����。
為評價cycleave qPCR的重復(fù)性和穩(wěn)定性,進行批內(nèi)和批間重復(fù)性試驗�,所有cycleave qPCR均重復(fù)3次,計算Ct和CV的平均值。結(jié)果顯示��,ts-11株批內(nèi)重復(fù)性CV為0.32%~0.82%���,非ts-11株批內(nèi)重復(fù)性CV為0.91%~1.13%�。此外���,ts-11株的批間重復(fù)性CV為0.40%~0.51%�����,非ts-11株的批間重復(fù)性CV值為0.63%~0.95%(表3)��。
表3 Cycleave qPCR批內(nèi)和批間重復(fù)性實驗結(jié)果
臨床樣品檢測
共采集300份免疫ts-11株35天后的雞上顎裂拭子���。ts-11株陽性率為70% (210/300),非ts-11株陽性率為20%(60/300)���,其余30份檢測結(jié)果均為陰性����,與商品化MG通用qPCR檢測試劑盒的結(jié)果一致性為100%����。
A公司分別在25日齡和45日齡免疫一次ts-11疫苗,B公司僅在21日齡免疫ts-11疫苗�����。在免疫后不同時間采集上顎裂拭子�,利用建立的cycleave qPCR方法評價免疫效果。結(jié)果顯示�����,兩次免疫的效果(圖5A)優(yōu)于一次免疫的效果(圖5B)����。
圖5. MG ts-11疫苗免疫后不同時間陽性率。A公司在25日齡和45日齡分別免疫一次(A)�����;B公司在21日齡免疫一次(B)�。
討論
MG ts-11的疫苗于1988年首次在澳大利亞上市,推廣20余年�����,在全球60多個國家應(yīng)用 (Ley等,1997; Muneta等���,2008; Noormohammadi and Whithear, 2019)����。該疫苗可持續(xù)定植于上呼吸道�����,阻止野毒株入侵��,保護關(guān)節(jié)和輸卵管��,提高雞蛋品質(zhì)(Vance等�����,2009 ; Jacob等���,2015)��。然而�,普通方法無法準(zhǔn)確區(qū)分ts-11株與非ts-11毒株�,因此�,難以了解MG在雞群中的流行狀態(tài)�����,特別是免疫過MG ts-11疫苗并且發(fā)生MG野毒感染的雞群�����。由于缺乏準(zhǔn)確快速的檢測方法����,極大地限制了區(qū)分疫苗株和非疫苗株�、評估臨床免疫效果、監(jiān)測雞群健康以及預(yù)防和控制MG感染的能力�����。
目前MG的診斷主要依靠分離培養(yǎng)���、抗體檢測�、分子生物學(xué)檢測 (Feberwee等���,2022)�。分離培養(yǎng)是檢測MG的金標(biāo)準(zhǔn),但致病性MG是一種生長緩慢且對培養(yǎng)條件相對苛刻的微生物����,可能需要長達3周的時間才能檢測出來。PCR方法具有特異性強�����、靈敏度高���、快速�����、簡便���、價格相對低廉等優(yōu)點,可用于直接檢測臨床樣本而不需要分離培養(yǎng)(Leurs等���,2022)���。
為了區(qū)分ts-11株和非ts-11株,科學(xué)家們進行了許多研究���。Raviv等開發(fā)了5種qPCR方法����,可將3種商品化疫苗株和2種實驗室候選疫苗株(F,ts-11��,6/85��,K5831和K5054)與野毒株(Rlow)進行區(qū)分���。然而,該方法的適用性有限�����,無法在更多場合中使用(Raviv等����,2008)。DNA指紋圖譜分析方法需要純培養(yǎng)����,重復(fù)性低,操作步驟冗長��,且缺乏實驗室間的比對數(shù)據(jù)(Hong等,2005 ; Naziri等��,2016 ; Mateen等�����,2021)��。熔解曲線法和基于瓊脂糖凝膠的錯配擴增突變檢測法(MAMAs)��,可區(qū)分MG疫苗株和野毒株�。然而,由于該檢測靈敏度適中����,DNA載量較低的臨床樣本可能會產(chǎn)生假陰性結(jié)果(Sulyok等,2019)�����。
因此���,需要開發(fā)一種簡單��、快速����、靈敏度高、特異性強的檢測方法��。特別是對于單堿基突變����,常規(guī)PCR無法進行區(qū)分,解決當(dāng)前的鑒別難題����。本研究開發(fā)的cycleave qPCR����,探針為循環(huán)探針,它是一種由RNA和DNA組成的雜合探針�,當(dāng)與RNase H共同使用時,該方法表現(xiàn)出高度靈敏性和特異性���。當(dāng)探針與互補的DNA序列形成雜合體時����,可以被RNase H切割����,解除淬滅抑制��,促進熒光物質(zhì)發(fā)出熒光(Yamada等��,2021)�。通過測量熒光強度可以實時對產(chǎn)物進行監(jiān)測��。因此����,這是一種高度特異性的檢測方法,即使只有一個堿基的變化也能識別差異��。與傳統(tǒng)的熒光PCR相比����,該探針一般由大約12個堿基組成,熒光報告基團與淬滅基團接近��,淬滅效果好�����,熒光背景低,信噪比高�。
本研究建立的cycleave qPCR方法可在1 h內(nèi)特異性區(qū)分ts-11株和非ts-11株,與AIV�����、IBV��、NDV等常見禽病病原無交叉反應(yīng)�����。Cycleave qPCR具有較高的敏感性���,對ts-11株的檢測極限為2.43拷貝/μL,對非ts-11株的檢測極限為1.65拷貝/μL�。批內(nèi)和批間CV均小于1.13%。在臨床樣品檢測中�����,cycleave qPCR與商品化MG通用qPCR試劑盒的一致性為100%��,可有效評價MG ts-11疫苗在雞群中的免疫效果�����。需要說明的是,該方法只能區(qū)分ts-11疫苗株和非ts-11疫苗株���,包括野毒株和其他疫苗株(F和6/85)�����。如果需要區(qū)分疫苗株(包括ts-11��、F和6/85)和野生株���,建議聯(lián)合使用其他方法。
綜上所述��,本研究建立了cycleave雙探針熒光定量PCR方法�。該方法操作簡單、靈敏度高�、特異性強、重復(fù)性好���、效率高�����。尤其是該方法可以同時檢測MG ts-11株和非ts-11株��。目前���,ts-11活疫苗是主要的MG疫苗��,在我國應(yīng)用廣泛����,在MG防控的臨床實踐中發(fā)揮了重要作用�����。Cycleave qPCR的建立將極大地促進MG ts-11活疫苗的應(yīng)用和MG感染的防控���,已在臨床上得到證實����。在我國�����,從商品雞群中根除MG的計劃已經(jīng)提上了日程����,本研究建立的cycleave qPCR方法將在MG感染的流行病學(xué)監(jiān)測中發(fā)揮重要作用。